Résumé :
La réponse immunitaire innée joue un rôle crucial dans la détection et la neutralisation des agents pathogènes ainsi que dans la réparation des tissus endommagés. Cette revue explore les mécanismes par lesquels les Pathogen-Associated Molecular Patterns (PAMP), les Damage-Associated Molecular Patterns (DAMP), les Pattern Recognition Receptors (PRR), et les inflammasomes orchestrent une réponse immunitaire coordonnée face à l’invasion microbienne et aux dommages tissulaires.
Introduction :
Le système immunitaire inné constitue la première ligne de défense de l’organisme contre les infections et les dommages tissulaires. La reconnaissance rapide et efficace des signaux de danger, qu’ils proviennent de pathogènes ou de cellules hôtes endommagées, est essentielle pour activer les réponses immunitaires appropriées. Cette reconnaissance est médiée par un ensemble complexe de récepteurs et de voies de signalisation impliquant les PAMP, les DAMP, les PRR, et les inflammasomes :
- PAMP et DAMP : Déclencheurs de la Réponse Immunitaire
Les PAMP sont des motifs moléculaires conservés présents sur les agents pathogènes, tandis que les DAMP sont des molécules libérées par les cellules hôtes en réponse à un dommage. Les deux servent de signaux d’alerte qui activent le système immunitaire inné. - PRR : Les Capteurs de Danger
Les PRR sont une classe diversifiée de récepteurs qui détectent les PAMP et les DAMP. Parmi les PRR, les Toll-like Receptors (TLR) et les NOD-like receptors (NLR) sont particulièrement importants pour leur capacité à initier des réponses inflammatoires et antivirales.
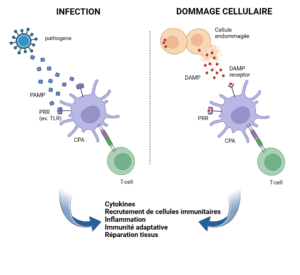
Figure 1 : Représentation schématique de la reconnaissance des PAMPs par les PRRs en réponse à une infection et des DAMPs en cas de danger cellulaire. Les deux signaux activent les cellules immunitaires qui produisent des cytokines, induisent une réponse inflammatoire, et facilitent l’immunité adaptative et la réparation tissulaire. À gauche, un pathogène est reconnu par les PRRs d’une cellule immunitaire, déclenchant une cascade de signalisation qui active les cellules T. À droite, une cellule endommagée libère des DAMPs, qui sont également reconnus par les PRRs, induisant une réponse similaire. Cette réponse coordonnée assure l’élimination des agents pathogènes et la guérison des tissus lésés.
- L’Inflammasome : Un Complexe Protéique Clé dans la Réponse Inflammatoire
Les inflammasomes sont des complexes protéiques cytosoliques qui jouent un rôle central dans la régulation de l’inflammation. Leur activation par des PAMP, DAMP, ou d’autres signaux de stress entraîne la maturation et la sécrétion de cytokines pro-inflammatoires, notamment l’IL-1β et l’IL-18.
Mécanismes d’Interaction et Voies de Signalisation
La compréhension des mécanismes d’interaction entre les PAMP, DAMP, PRR, et inflammasomes, ainsi que des voies de signalisation impliquées, est cruciale pour élucider la complexité de la réponse immunitaire innée. Ces interactions orchestrées déclenchent une série d’événements cellulaires qui mènent à l’activation de réponses immunitaires spécifiques et adaptatives.
Activation des PRR par les PAMP et DAMP
Les PRR, tels que les TLR et NLR, reconnaissent spécifiquement les PAMP et DAMP, ce qui déclenche une cascade de signalisation intracellulaire. Les TLR, par exemple, sont situés à la surface cellulaire ou dans les endosomes et reconnaissent des motifs spécifiques de PAMP et DAMP. L’engagement d’un TLR par son ligand conduit à l’activation de la voie MyD88-dépendante ou TRIF-dépendante, aboutissant à la translocation du facteur de transcription NF-κB dans le noyau et à l’expression de gènes pro-inflammatoires.
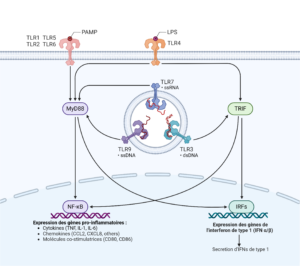
Figure 2 : Schéma de la signalisation des Toll-like Receptors (TLR) : Cette figure illustre les voies de signalisation activées par la reconnaissance des PAMP par les TLRs. La liaison des PAMP aux TLR1, TLR2, TLR4, TLR5 et TLR6 active la voie MyD88, qui entraîne la translocation de NF-κB dans le noyau et l’expression de gènes pro-inflammatoires. Parallèlement, les TLR3, TLR7 et TLR9, qui reconnaissent des motifs d’acides nucléiques spécifiques, activent la voie TRIF, conduisant à l’expression de gènes de l’interféron de type I via les facteurs de transcription IRFs. Cette cascade de signalisation est essentielle pour la réponse immunitaire innée, induisant la production de cytokines, de chimiokines, de molécules d’adhésion endothéliale et de molécules co-stimulatrices.
Rôle des NLR et l’Activation de l’Inflammasome
Les NLR jouent un rôle central dans la formation de l’inflammasome. L’activation de NLRP3, un membre de la famille des NLR, par des PAMP, DAMP, ou signaux de stress cellulaire, conduit à l’assemblage de l’inflammasome NLRP3. Ce complexe recrute l’adaptor ASC et la pro-caspase-1, facilitant la conversion de la pro-caspase-1 en caspase-1 active. La caspase-1 catalyse ensuite la maturation de l’IL-1β et de l’IL-18, des cytokines clés dans la médiation de la réponse inflammatoire.
Signalisation en Aval et Réponses Immunitaires
La signalisation en aval de l’activation des PRR et de l’inflammasome implique plusieurs voies, y compris la voie JAK-STAT, qui est essentielle pour la production de type I et type II d’interférons (IFN) en réponse aux infections virales. Ces voies contribuent à un état antiviral, stimulent la présentation de l’antigène, et facilitent la communication entre l’immunité innée et adaptative.
Régulation des Réponses Immunitaires
La régulation de ces réponses est assurée par des mécanismes de feedback négatif et des modulateurs post-traductionnels, qui assurent que la réponse immunitaire est proportionnelle à la menace et évite les dommages excessifs aux tissus hôtes. Les protéines de la famille SOCS, par exemple, sont induites par des cytokines et inhibent la signalisation JAK-STAT pour limiter les réponses inflammatoires.
Implications Cliniques et Perspectives :
La compréhension approfondie de l’interaction entre les PAMP, DAMP, PRR, et inflammasomes ouvre des voies prometteuses pour le développement de nouvelles stratégies thérapeutiques. L’approche BI(G)MED visant à moduler ces interactions améliore les réponses immunitaires contre les infections, réduit les réponses inflammatoires pathologiques, et favorise la réparation tissulaire.
Pour aller plus loin, voici quelques publications majeures dans le domaine :
- Janeway CA Jr, Medzhitov R. “Innate Immune Recognition.” Annual Review of Immunology. 2002;20:197-216.
Un article fondateur décrivant comment le système immunitaire reconnaît les agents pathogènes à travers les PRRs. - Kumar H, Kawai T, Akira S. “Pathogen Recognition by the Innate Immune System.” International Reviews of Immunology. 2011;30(1):16-34.
Cet article fournit une vue d’ensemble complète sur la reconnaissance des pathogènes par le système immunitaire inné, en mettant l’accent sur les PRRs. - Takeuchi O, Akira S. “Pattern Recognition Receptors and Inflammation.” Cell. 2010;140(6):805-820.
Un article clé sur le rôle des récepteurs de reconnaissance de motifs dans l’initiation des réponses inflammatoires. - Medzhitov R. “Origin and Physiological Roles of Inflammation.” Nature. 2008;454:428-435.
Explore les origines et les rôles physiologiques de l’inflammation, offrant un contexte important pour comprendre l’activation des inflammasomes. - Schroder K, Tschopp J. “The Inflammasomes.” Cell. 2010;140(6):821-832.
Une revue fondamentale sur les inflammasomes, leur mécanisme d’action et leur importance dans les maladies humaines. - Latz E, Xiao TS, Stutz A. “Activation and Regulation of the Inflammasomes.” Nature Reviews Immunology. 2013;13(6):397-411.
Décrit en détail l’activation et la régulation des inflammasomes, soulignant leur rôle central dans l’immunité innée. - Rock KL, Latz E, Ontiveros F, Kono H. “The Sterile Inflammatory Response.” Annual Review of Immunology. 2010;28:321-342.
Cet article explore la réponse inflammatoire stérile, y compris le rôle des DAMPs dans l’initiation de l’inflammation sans la présence de pathogènes. - Bianchi ME. “DAMPs, PAMPs and Alarmins: All We Need to Know About Danger.” Journal of Leukocyte Biology. 2007;81(1):1-5.
Un aperçu éclairant sur les molécules de danger, y compris les DAMPs et PAMPs, et leur importance dans la réponse immunitaire.